Retiran más medicamentos por exceso de una impureza
La más reciente retirada del mercado de medicamentos para la presión arterial procede de Aurobindo Pharma, que retiró dos lotes de comprimidos de Quinapril e Hidroclorotiazida por contener una cantidad excesiva de la impureza nitrosamina N-Nitroso-Quinapril.
Esto es lo que debe saber.
¿Qué medicamentos para la presión arterial se retiraron?
La retirada abarca los lotes QE2021005-A y QE2021010-A de Quinapril e Hidroclorotiazida Comprimidos USP 20mg /12.5mg en frascos de 90 unidades de Aurobindo Pharma con fecha de caducidad de enero de 2023.
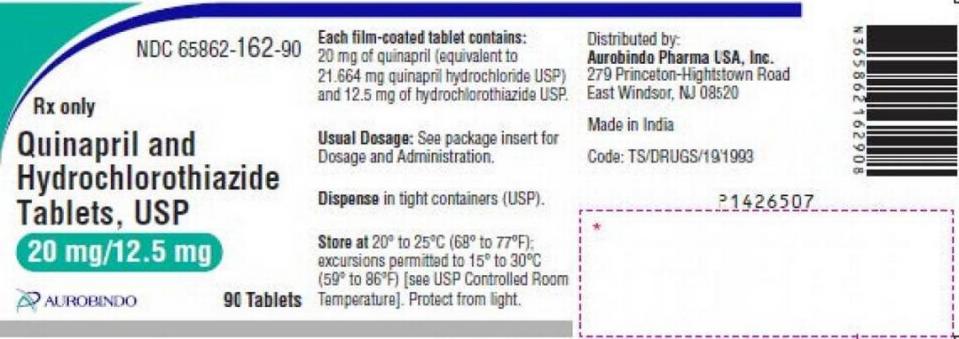
El aviso de retirada escrito por la empresa y publicado por la FDA describe así las tabletas: “Comprimidos de color rosa, ranurados, de forma redonda, biconvexos, recubiertos con película, con la inscripción ‘D’ en el lado ranurado y ‘19’ en el otro lado”.
El peligro
Aunque la declaración de riesgo del aviso de retirada del mercado comienza con: “Las nitrosaminas son comunes en el agua y los alimentos, incluyendo las carnes curadas y a la parrilla, los productos lácteos y las verduras. Todo el mundo está expuesto a algún nivel de nitrosaminas”, continúa con: “Estas impurezas pueden aumentar el riesgo de cáncer si las personas se exponen a ellas por encima de los niveles aceptables durante mucho tiempo”.
Lo que debe hacer ahora
No está en peligro inmediato. Pero póngase en contacto con su médico o farmacéutico para discutir si debe seguir tomando este medicamento hasta que se decida un tratamiento de sustitución.
Si tiene preguntas sobre la devolución de los medicamentos retirados, llame a Qualanex, que se encarga de la retirada de Aurobindo, al 888-504-2014, de lunes a viernes, de 8 a.m. a 5 p.m., hora del este.
Si estos o cualquier otro medicamento le causan un problema, después de notificarlo a un profesional médico hágalo saber a la FDA a través de su página MedWatch Adverse Event o llenando un formulario que puede obtener llamando al 800-332-1088. A continuación, notifique al fabricante, Aurobindo en este caso, al 866-850-2876 (opción 2), las 24 horas al día, los 7 días a la semana o enviando un correo electrónico a pvg@aurobindousa.com.

 Yahoo Noticias
Yahoo Noticias 
