Aprueban una nueva droga para las etapas tempranas del Alzheimer: podría demorar el deterioro cognitivo
NUEVA YORK.– La Administración de Alimentos y Medicamentos de Estados Unidos (FDA, por sus siglas en inglés) aprobó hoy una nueva droga para la enfermedad de Alzheimer, la última de una nueva clase de tratamientos que han sido recibidos con una mezcla de esperanza, desilusión y escepticismo.
La droga se llama donanemab, se comercializará con el nombre Kinsula y en estudios clínicos ha demostrado demorar levemente el ritmo de deterioro cognitivo en las etapas tempranas de la enfermedad. Pero también entraña riesgos significativos, como la inflamación o el sangrado del cerebro.
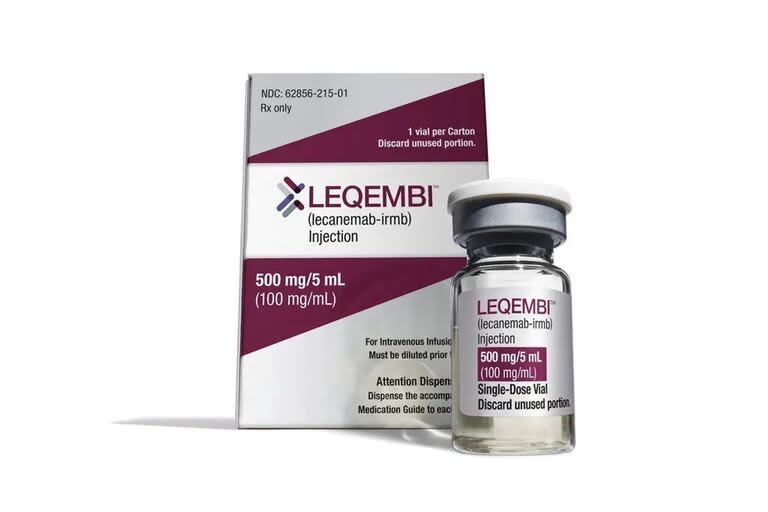
Kinsula es fabricada por laboratorios Eli Lilly y es similar al Leqembi, otra droga aprobada el año pasado. En ambos casos se trata de infusiones intravenosas que atacan la proteína involucrada en el desarrollo de la enfermedad, y las dos tienen la capacidad de demorar varios meses la aparición de la demencia. Los riesgos son también iguales para ambas drogas. El Leqembi, de laboratorios Eisai y Biogen, se administra cada dos semanas, mientras que Kinsula se aplica una vez al mes.
Pero Kinsula tiene una diferencia significativa que puede resultar atractiva para pacientes, médicos y servicios médicos por igual: la empresa Eli Lilly dice que los pacientes pueden dejar de aplicarse la droga una vez que ha eliminado la proteína amiloide, que es la que se acumula en forma de placas en el cerebro de las personas con Alzheimer.
“Cuando el objetivo fue eliminado, el paciente puede dejar de tomarla”, dice Anne White, vicepresidenta ejecutiva del laboratorio y presidente de su división de neurociencia. White sostiene que eso reduce el costo total y los incordios del tratamiento, así como el riesgo de efectos colaterales.
Un paso gradual
Kisunla y Leqembi son considerados un paso gradual más en la búsqueda de tratamientos eficaces contra el Alzheimer. De hecho, algunos expertos afirman que hasta es posible que el deterioro no se desacelere lo suficiente como para que los pacientes o sus familias lo noten.
Estos medicamentos pertenecen a una nueva clase de fármacos que enfrentan los procesos biológicos subyacentes del Alzheimer atacando la proteína amiloide, que comienza a acumularse en el cerebro años antes de que aparezcan los síntomas. El primer medicamento de esa clase en recibir aprobación de la FDA fue Aduhelm en 2021, pero el año pasado el fabricante suspendió su comercialización, ya que no había pruebas suficientes de un beneficio para los pacientes. Hasta el momento, no existen tratamientos que detengan o reviertan la pérdida de memoria u otros problemas cognitivos.
Algunos expertos en Alzheimer son escépticos respecto de los medicamentos antiamiloides y creen que los riesgos superaban los posibles y leves beneficios.
Michael Greicius, neurólogo de la Facultad de Medicina de la Universidad de Stanford, dice que nunca recetó Leqembi y que tampoco le ofrecería Kisunla a sus pacientes. Según Greicius, si los medicamentos fueran efectivos, los datos deberían mostrar que los pacientes a quienes se les extrajo más amiloide del cerebro experimentaron tasas más lentas de deterioro cognitivo, así como los medicamentos contra el VIH demostraron que cuanto más reducen la carga viral de un paciente, mejor será su salud y su expectativa de vida.
Pero hasta ahora, señala el especialista, “en ninguno de esos estudios hay correlación entre la eliminación de placas amiloides y una respuesta clínica en pacientes individuales”, y eso deja planteada la duda “de cómo funciona este fármaco, si es que funciona, al que como médico me resulta bastante frustrante”.
Para otros expertos, es muy valioso poder brindarles esta opción a los pacientes aunque el beneficio sea modesto.
B. Joy Snider, profesor de neurología en la Facultad de Medicina de la Universidad de Washington, que participó en ensayos de ambos medicamentos y anteriormente trabajó como consultor tanto para Eisai como para Lilly, señala que aunque la desaceleración del deterioro “no es muy grande”, puede ser crucial para la vida de una persona.
“Al menos a nivel de grupo, la eliminación del amiloide se correlaciona con una desaceleración del avance de la enfermedad”, apunta Snider. “Establecer esa misma correlación en un paciente individual va a ser difícil”, explica el neurólogo, porque los problemas de memoria y pensamiento son fluctuantes, y porque durante los ensayos clínicos “no hay manera de saber si el paciente ha tenido un buen día o un mal día”.
Ensayo
En un ensayo sobre 1736 pacientes con principio de Alzheimer, personas con deterioro cognitivo leve o demencia leve, el deterioro se desaceleró entre 4 meses y medio y 7 meses y medio durante los 18 meses en los que les administraron donanemab, en comparación con los que recibieron el placebo. En una escala cognitiva de 18 puntos, el deterioro cognitivo del grupo general de pacientes que recibieron el fármaco fue un 29% más lento que en el grupo de placebo, para una diferencia de siete décimas de punto.
Casi la mitad de los que recibieron donanemab conservaron el mismo nivel cognitivo al año de iniciado el estudio, en comparación con un 29% en el grupo que recibió el placebo.
Aproximadamente una cuarta parte de los que tomaron donanemab experimentaron hinchazón o sangrado en el cerebro. Si bien la mayoría de los casos fueron leves o asintomáticos, alrededor del 2% fueron graves y en tres pacientes los efectos secundarios estuvieron relacionados con su fallecimiento.
El ensayo con donanemab tuvo tasas más altas de inflamación y sangrado que el ensayo con Leqembi, pero las comparaciones son difíciles debido a las diferencias entre los pacientes y otros factores.
Según los expertos, hay varias incógnitas sobre la interrupción del tratamiento después de la eliminación de las placas amiloides. “¿Hay que retomarlo en algún momento? –se pregunta Snider–. ¿Tenemos que reemplazarlo por otra cosa?”
Para esas preguntas, los científicos de Lilly todavía no tienen respuesta. Sims estima que tienen que pasar casi cuatro años para que los niveles de amiloide vuelvan a superar el umbral, y potencialmente una década para que alcancen el volumen que tenían los pacientes antes de comenzar el tratamiento.
A algunos expertos les preocupa que tanto énfasis en los fármacos antiamiloides pueda disuadir a los pacientes de participar en ensayos de otros tratamientos que podrían ser mejores. “Si miramos el cuadro completo, creo que esto inclina demasiado la balanza hacia un solo lado y está frenando la investigación y el avance de otros tratamientos”, apunta Greicius.
Actualmente hay decenas de drogas contra el Alzheimer en etapa de ensayos clínicos, incluidos medicamentos que atacan otros rasgos importantes de la enfermedad, como los ovillos de tau y la neuroinflamación.
“Esperemos que esto sea solo el comienzo”, dice Snider.
Por Pam Belluk
Traducción de Jaime Arrambide

 Yahoo Noticias
Yahoo Noticias 